Ambrosius Josef Martin Dörr, Melissa Scoparo, Barbara Caldaroni, Gabriele Magara, Antonia Concetta Elia
Tratto da: "Caratterizzazione e diffusione delle specie aliene acquatiche e di ambienti umidi in Umbria" (Capitolo 8)
Riassunto
Le specie di gambero d’acqua dolce aliene presenti sul territorio umbro sono tre: il gambero rosso della Louisiana Procambarus clarkii con undici popolazioni, il gambero americano comune Orconectes limosus con du e il gambero turco Astacus leptodactylus con una. P. clarkii è la specie invasiva in maggiore espansione ed è ormai ben acclimatata nei laghi Trasimeno, Piediluco, Corbara, Alviano e Pietrafitta e in almeno sei corsi d’acqua.
Questa specie inoltre ha già raggiunto, quasi sicuramente con l’aiuto dell’uomo, il Fiume Vigi, unico corso d’acqua in Umbria dove esiste ancora una continuità con la popolazione del gambero autoctono Austropotamobius pallipes del Torrente Argentina. Prima del 1999 nessuna popolazione di gambero d’acqua dolce alloctono era stata segnalata per l’Umbria. Nel 2000 il gambero rosso si era già ben acclimatato nel lago Trasimeno e lo dimostrano gli ottimi valori degli indici di condizione, la lunghezza teorica massima del cefalotorace e l’elevata velocità di accrescimento per ambedue i sessi. P. clarkii può raggiungere i 5 anni di età. Pur essendo una specie che predilige acque temperate, nel Trasimeno compie la muta a tutte le temperature e spesso a quelle basse. L’incubazione delle uova pleopodali e l’accrescimento dei giovani avvengono a temperature comprese tra 5°C e 17°C, indicando che la specie potrebbe potenzialmente accrescersi e riprodursi anche negli ambienti freschi dei corsi d’acqua montani, dove sono collocate le popolazioni residue di A. pallipes. Inoltre, per il lago Trasimeno, esiste la concreta possibilità di una competizione interspecifica tra P. clarkii e i due decapodi autoctoni come il granchio di fiume Potamon fluviatile e il gamberetto Palaemonetes antennarius. Analisi fungine effettuate sull’esoscheletro del gambero della Louisiana hanno rivelato un’elevata diversità di specie; 33 taxa per 20 generi. È stata riscontrata anche la presenza di colonie batteriche nel 58% degli individui. L’oomicete Aphanomyces astaci, responsabile della famigerata peste del gambero, non è mai stato riscontrato. Phoma glomerata invece, una specie fungina mai segnalata prima per le acque dolci in Italia e potenzialmente patogena per la flora, la fauna e l’uomo, rappresenta la specie dominante, che è stata riscontrata durante tutto l’anno di campionamento sul 67.4% del campione di gambero rosso. I taxa fungini potenzialmente pericolosi per la salute dell’uomo e degli animali sono: Acremonium kiliense, Aspergillus candidus, Aspergillus fumigatus, Aspergillus terreus, Aureobasidium pullulans, Fusarium dimerum, Fusarium oxysporum, Fusarium verticillioides, Paecilomyces lilacinus, e Penicillium chrysogenum. Le specie microfungine fitopatogene riscontrate suscitano preoccupazione, se si considera che questo invasore è già ritenuto un vero e proprio “flagello” per il danno causato ad argini, sistemi di irrigazione e germinelli. P. clarkii può spostarsi inoltre anche diversi kilometri al giorno sulla terra ferma e di conseguenza la possibilità di diffusione di patologie da parte di questa specie potrebbe rappresentare un ulteriore elemento negativo legato alla sua presenza sul territorio. Data la mancanza di competitori, l’elevata fertilità, la plasticità del suo ciclo riproduttivo e la possibilità di resistere a estreme condizioni ambientali, la sua completa eradicazione dagli ambienti colonizzati sembra impossibile. Per di più P. clarkii è spesso venduto vivo nelle pescherie, agli acquariofili e ai bambini durante le fiere di paese e questa prassi potrebbe favorire ulteriormente la sua diffusione essendo estremamente resistente all’essicamento, al maneggiamento e al trasporto. Pertanto, essendo anche portatore di patogeni, l’utilizzo di questa risorsa deve essere attentamente valutata anche in termini di rischi per la salute umana e per quanto riguarda la sicurezza nella manipolazione. In futuro, la continua riduzione delle popolazioni umbre del gambero di fiume Austropotamobius pallipes potrebbe essere attribuita anche alla presenza e alle interazioni, dirette ed indirette, con il gambero rosso, ben acclimatato nei maggiori laghi umbri e in espansione in tutta la regione.
Presenza e distribuzione delle specie di gamberi alloctoni in Umbria
Le specie di gambero d’acqua dolce aliene presenti sul territorio umbro sono tre; il gambero rosso della Louisiana Procambarus clarkii con almeno undici popolazioni, il gambero americano comune Orconectes limosus con due e il gambero turco Astacus leptodactylus con una. Orconectes limosus (Rafinesque, 1817) o gambero comune americano è stato introdotto in Italia già nel 1860. È molto simile per aspetto e dimensione al gambero autoctono, ma è una specie più aggressiva, resistente e feconda. Le sue dimensioni massime sono 12 cm di lunghezza per un peso di 40 g. L’alimentazione è onnivora. La maturità sessuale avviene al secondo anno e raramente supera i 4 anni di vita. La specie ha un rapido ritmo di accrescimento e scarse esigenze da un punto di vista ambientale. Probabilmente è giunto nel lago di Piediluco dal lago del Salto situato più a monte dove era sintopico con il gambero turco Astacus leptodactylus Eschscholtz,1823 species complex. Il gambero turco, specie europea, è stato introdotto in Italia all’inizio degli anni ottanta, in acquacultura, per colmare la domanda culinaria di gamberi d’acqua dolci. È il gambero di dimensioni maggiori rispetto a quelli presenti in Umbria. Può raggiungere 20 cm di lunghezza per un peso di 200 g. I maschi maturano sessualmente al secondo anno e le femmine al quarto. Onnivoro, può superare i 5 anni di vita. Robusto, tollera bene forti carichi inquinanti, basse concentrazioni di ossigeno disciolto ed elevati scarti termici stagionali. La fecondità e la velocità di accrescimento sono più elevate di A. pallipes. Resiste discretamente alle malattie, ma non alla peste dei gamberi. Infine, come ultimo arrivato nel lago di Piediluco, probabilmente dal vicino lago di Ventina, è il gambero rosso della Louisiana. P. clarkii che è stato segnalato per la prima volta nel lago Trasimeno nel 1999, qualche anno dopo nel lago di Piediluco e nel Fiume Tevere. Da circa 10 anni è presente nei maggiori laghi umbri. Desta preoccupazione il ritrovamento di un esemplare di colore blu sul torrente Sciola, un affluente del Fiume Chiascio, scappato probabilmente da un allevamento nelle vicinanze. (Figura 1,vedi schede in Appendice del Volume). P. clarkii è la specie invasiva in maggiore espansione ed è ormai ben acclimatata nei laghi Trasimeno, Piediluco, Corbara, Alviano e Pietrafitta e in almeno sei corsi d’acqua. Inoltre questa specie ha già raggiunto, quasi sicuramente con l’aiuto dell’uomo, il Fiume Vigi, unico corso d’acqua in Umbria dove esiste ancora una continuità con la popolazione del gambero autoctono A. pallipes del Torrente Argentina. I risultati relativi allo studio delle popolazioni indigene e non presenti attualmente in Umbria, indicano una rarefazione delle popolazioni autoctoni tutt’ora in atto, e contemporaneamente un’invasione delle popolazioni di P. clarkii. (Figura 1).
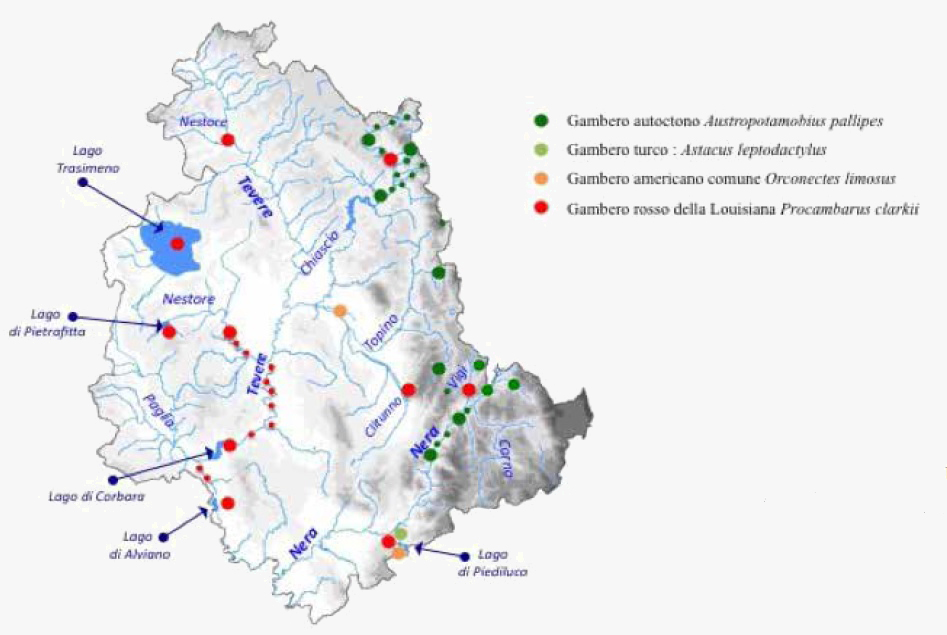
Figure 1 - Presenza delle specie di gamberi in Umbria (2018)
Il gambero rosso della Louisiana Procambarus clarkii
Il gambero rosso della Louisiana P. clarkii, conosciuto anche come gambero delle paludi o con il più enfatizzato appellativo di “gambero killer”, è un crostaceo decapode della famiglia Cambaridae originario del centro-sud degli Stati Uniti e del nord-est del Messico. Esso è stato introdotto volontariamente in quasi tutti gli ambienti di acqua dolce del mondo, ad eccezione dell’Australia e dell’Antartico (Hobbs et al., 1989). Sebbene questa specie sia in grado di attuare efficaci mezzi di dispersione, la sua diffusione è stata favorita dall’attività dell’uomo, che per anni l’ha esportato permettendogli di superare le barriere naturali. Una conseguenza negativa è la profonda alterazione della composizione delle comunità preesistenti per lo stabilirsi di rapporti di competizione per le risorse trofiche e spaziali, per la predazione di uova, giovani o adulti di specie indigene e per il trasporto di parassiti e agenti patogeni da parte degli invasori. La specie aliena P. clarkii è stata indicata come uno di questi pericolosi invasori, soprattutto per le sue caratteristiche ecologiche e biologiche, nonché per la sua estrema aggressività, ragione per la quale è il decapode d’acqua dolce più diffuso al mondo. Esiste quindi la concreta possibilità di un impatto negativo su tutte le comunità preesistenti in Umbria e dunque anche sulle residue popolazioni del gambero di fiume Austropotamobius pallipes ma anche sulle altre due specie di decapodi autoctoni, il granchio di fiume e il gamberetto. Per il lago Trasimeno, non può essere esclusa una competizione interspecifica tra il gambero rosso e i decapodi autoctoni Potamon fluviatile (Herbst 1785) e Palaemonetes antennarius (Milne Edwards, 1837).
Quest’ultima specie rappresenta un anello fondamentale nella rete trofica del lago, costituendo l’alimento preferito di molte specie ittiche, anche d’interesse commerciale (Traversetti et al., 2016). Nessun gambero d’acqua dolce, autoctono o alloctono, era presente nel lago Trasimeno fino al 1999, anche se rarissime catture di P. clarkii vennero segnalate dai pescatori locali a partire dalla fine degli anni ’80 del secolo scorso (Dörr et al., 2001).
Storia dell’invasione in Europa e in Italia
Da sempre l’uomo utilizza i gamberi d’acqua dolce come fonte primaria di proteine animali. I gamberi erano apprezzati come alimento sia durante l’impero romano sia durante il medioevo, quando gli alchimisti assegnavano a questi animali “misteriosi” il segreto della trasmutazione. Oggi questi crostacei sono considerati un genere alimentare di lusso in diversi paesi del mondo. In particolare, una stima (in difetto) fornita dalla Food and Agricoltural Organisation nel 1989, mostrò come la domanda mondiale di gamberi d’acqua dolce tra gli anni 1986-89 fu di 42-56000 t/anno, soprattutto per i mercati di USA, Australia, Kenya, Turchia ed Europa (Holdich, 1993). Negli Stati Uniti, si stima che nel solo stato della Louisiana siano stati venduti oltre 45.000.000.000 esemplari di gambero rosso all’anno nell’ultimo decennio. La richiesta di specie non particolarmente esigenti, adatte all’acquacoltura in allevamenti intensivi o semi- intensivi, è supportata quindi da forti ragioni economiche. Per quanto riguarda l’Europa, la prima introduzione, a fini commerciali, avvenne nel giugno 1973 nella provincia spagnola di Badajoz (Hasburgo-Lorena, 1986) attraverso un’importazione significativa (500 kg) proveniente dalla Louisiana. Una volta colonizzata la Spagna, la specie si è diffusa in tutta l’Europa centro-occidentale (Portogallo, Francia, Svizzera, Germania, Olanda, Inghilterra e Cipro). Lo scopo delle prime introduzioni, sostenute e incoraggiate sia dalle istituzioni locali sia dalla comunità scientifica, era duplice: da una parte, le ovvie ragioni economiche legate all’immissione, che fu effettuata soprattutto in aree povere in cui si voleva svilupparne il commercio; dall’altra, si pensò erroneamente che P. clarkii sarebbe andato a occupare la nicchia trofica lasciata vuota dalle specie autoctone Austropotamobius pallipes (Lereboullet, 1858) e Astacus astacus (Linneaus, 1758) che in Europa avevano subìto un declino generale, dovuto alla pesca intensiva, alla perdita di habitat e al diffondersi di una micosi conosciuta come “peste del gambero”. Si può affermare, quindi, che il potenziale di questa specie, quale invasore di successo, venne enormemente sottovalutato. Nel corso di tre decadi P. clarkii si è diffuso ed è diventato dominante in gran parte dell’Europa e della regione mediterranea. Le prime introduzioni risalgano al 1989 (Delmastro, 1992) nell’Italia settentrionale, dove la specie si è poi diffusa in numerosi laghi e corsi d’acqua dalla Pianura Padana. A oggi è stato segnalato in Trentino, Lombardia, Piemonte, Liguria, Veneto, Friuli Venezia Giulia ed Emilia Romagna. Nell’ Italia centrale, la specie è presente in Toscana, Umbria, Marche, Abruzzo e Lazio. Nell’Italia meridionale e insulare la specie è presente in Basilicata, nel lago Tarsia in provincia di Cosenza in Calabria, nelle province di Trapani in Sicilia e di Sassari e Cagliari in Sardegna.
Caratteristiche ecologiche
P. clarkii è il gambero d’acqua dolce più diffuso al mondo, essendo dotato di straordinaria valenza ecologica. Questo decapode è, infatti, in grado di colonizzare la maggior parte degli ambienti d’acqua dolce e salmastra, prediligendo i corpi idrici a lento scorrimento o stagnanti e i bacini eutrofici, caratterizzati da scarsa ossigenazione e da forti variazioni di temperatura (Dörr et al., 2006). Può sopravvivere in questi ambienti ipossici grazie alla capacità di utilizzare ossigeno atmosferico per i processi respiratori. L’r-strategia è alla base del suo successo. Sono definite specie r-strateghe quelle che, occupando ambienti estremamente instabili, sono soggette a pressioni selettive legate alla limitatezza delle risorse (spazio, cibo, ecc.) e impiegano gran parte della loro energia nella riproduzione. P. clarkii ne mostra, infatti, le caratteristiche, quali maturità sessuale precoce a tre mesi, rapido tasso di crescita ed elevato investimento nella riproduzione. È una tra le più prolifiche specie di gambero (700-750 uova/femmina) ed è in grado di riprodursi durante tutto l’anno. P. clarkii è capace di colonizzare un’ampia varietà di ambienti, in quanto sembrerebbe essere in grado di produrre popolazioni adatte e specifiche ad ogni habitat (Dörr & Scalici, 2013). Inoltre, il rilascio dei giovani individui dopo la schiusa da parte delle femmine può essere progressivo e durare anche un mese; ciò significa che il rilascio dell’ultimo giovane potrebbe coincidere con la seconda o terza muta della prima schiusa (Figura 2) (Gutiérrez- Yurrita & Montes, 1999). Figura 2 Uova pleopodali di P. clarkii prima della schiusa (A) e durante (B), giovanili di stadi diversi (C) e (D) raccolti sotto l’addome della stessa femmina.
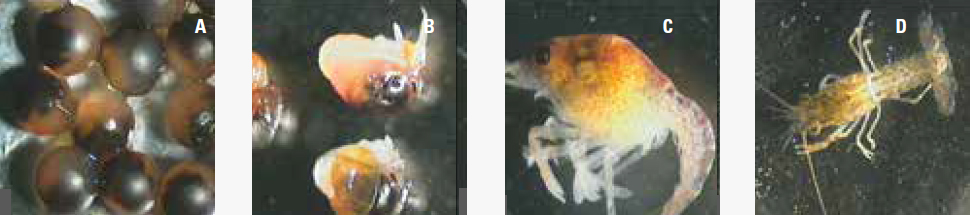
Figura 2 - Uova pleopodali di P. clarkii prima della schiusa (A) e durante (B), giovanili di stadi diversi (C) e (D) raccolti sotto l’addome della stessa femmina. Foto di A.J.M. Dörr.
Impatto del gambero rosso della Louisiana sul sistema socio-economico, sugli ecosistemi e aspetti sanitari legati alla specie
Alcune ripercussioni economiche e sociali devono essere prese in considerazione riguardo l’introduzione di P. clarkii in Europa. Sebbene in alcune aree l’allevamento e la pesca di P. clarkii rappresentino una temporanea fonte di guadagno, nella maggior parte dei casi i danni superano di gran lunga gli utili. Innanzitutto, la presenza del gambero può causare un decremento significativo delle comunità di vertebrati e invertebrati e può influenzare negativamente le attività economiche legate a pesca e agricoltura (Geiger et al., 2005). Negli anni ottanta il Consorzio Pesca ed Acquicoltura del Trasimeno prese in considerazione la sua introduzione per ampliare la pesca professionale con un prodotto di pregio. Tale intervento non è stato effettuato per evitare potenziali problemi ecologici al lago. La buona qualità delle sue carni ne ha comunque consentita la diffusione per opera dell’uomo. Dall’inizio del 2000 la popolazione del gambero rosso della Louisiana nel lago Trasimeno è rapidamente aumentata, fino a diventare oggetto di pesca professionale per poi essere venduto nei mercati locali. Oggi P. clarkii è parte integrante della gastronomia lacustre, ed è il piatto forte della sagra del pesce sfilettato di Sant’Arcangelo e viene spesso servito di venerdì alla mensa degli studenti dell’Università degli Studi di Perugia. Attualmente è venduto anche fuori provincia dalle cooperative dei pescatori professionali del lago. Il gambero è stato bene accolto della parte dei consumatori che lo hanno fatto diventare una fonte di reddito aggiuntivo per i pescatori del lago e il suo prelievo su larga scala è sicuramente il metodo migliore per contenerne la popolazione del lago (Natali, 2010).
La pesca, sia ricreativa che professionale, nonché l’allevamento di questo gambero è in rapido aumento ed è in espansione in tutto il mondo, grazie al suo alto rendimento economico, ragione per la quale sono necessari futuri studi riguardanti lo stato sanitario di questa specie. Inoltre questo crostaceo è venduto agli acquariofili e ai bambini durante le feste e fiere di paese al posto dei pesci rossi perché ancora più resistenti alla manipolazione. La sua comparsa in ambienti naturali ed artificiali è in relazione all’iniziativa di privati che, entrati in possesso di esemplari vivi, e un volta stancatosene, li hanno poi liberati in ambienti acquatici. Questa usanza potrebbe favorire ulteriormente la sua diffusione.
Impatto sugli ecosistemi
Le invasioni biologiche causano gravi perdite di biodiversità in tutto il mondo e hanno forti ripercussioni in particolare su ecosistemi vulnerabili, come quelli d’acqua dolce (Garcia-Berthou et al., 2005). Procambarus clarkii è un predatore onnivoro, opportunista nonché consumatore generalista estremamente attivo di giorno e di notte. La suddetta specie s’inserisce nella rete trofica (Mancinelli et al., 2018) agendo da specie keystone causando un decremento significativo della biomassa e della ricchezza delle specie situate ai livelli trofici inferiori (Renai & Gherardi, 2004). In generale, esercita una pressione predatoria alla quale le specie native spesso non sono adattate. Gli invertebrati acquatici, principalmente artropodi e gasteropodi, sono tra le principali prede animali. La dieta comprende anche uova e larve di anfibi. L’impatto sulle specie ittiche presenti negli ecosistemi colonizzati rimane ancora da indagare nel dettaglio, ma s’ipotizza che la predazione venga esercitata principalmente dagli individui di gambero adulto su uova e avannotti. Gli effetti negativi più evidenti riguardano le specie di macrofite acquatiche sommerse e semi-sommerse.
Negli ambienti mediterranei P. clarkii è stato più volte citato come responsabile della scomparsa di alcune specie vegetali del sud dell’Europa (Geiger et al., 2005). Questa specie è inoltre riconosciuta a livello internazionale come un vero e proprio “flagello delle risaie”, sia perché si nutre di semi e germogli, sia per il suo comportamento fossorio che danneggia argini e sistemi d’irrigazione, causandone spesso il crollo (Correia, 2003).
Impatto di P. clarkii sulla specie autoctona Austropotamobius pallipes
A. pallipes, il gambero di fiume autoctono italiano, è stata classificata come una specie “in pericolo” dall’International Union for Conservation of Nature and Natural Resources (IUCN, Füreder et al, 2010) e tutelata dalla “Direttiva Habitat” 92/43/CEE. In Umbria le presenze attuali del gambero nativo sono limitate quasi esclusivamente ai tratti montani dei corsi d’acqua non interessati dall’ antropizzazione e riguardano maggior parte il versante umbro della catena appenninica umbro-marchigiana (Monte Cucco).
Le poche popolazioni sono frazionate con l’unica eccezione rappresentata dal complesso del Fiume Vigi, del Torrente Argentina e del Fosso delle Rote/ Molino nella località di Sellano dove esiste una condizione di connessione diretta con P. clarkii. L’invasione di P. clarkii, iniziata dal 1999 nel Lago Trasimeno (Dörr et al., 2001), sembra inarrestabile e la sua odierna distribuzione è preoccupante, essendo già entrata in contatto con A. pallipes nel Fiume Vigi e avendo sostituito la popolazione del gambero autoctono del Fiume Clitunno (Figura 3).
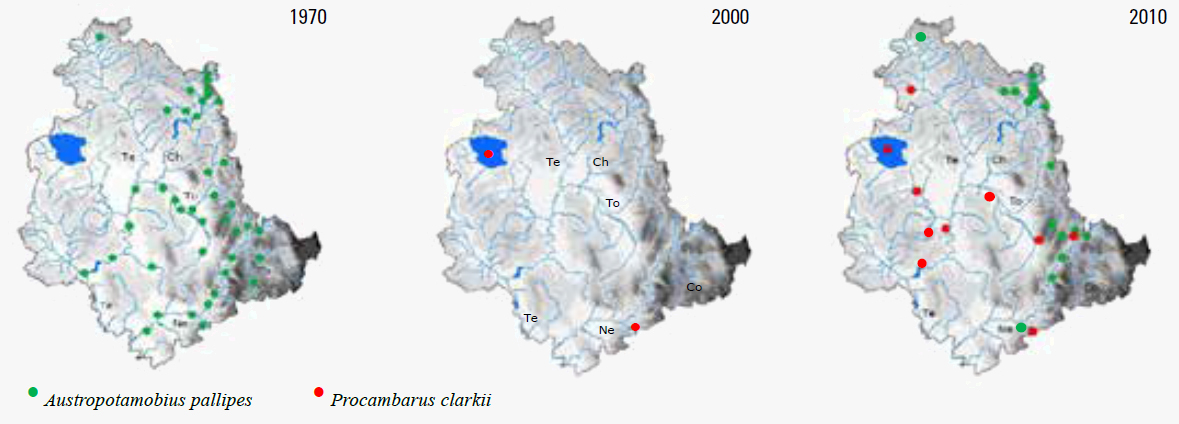
Figura 3 - Distribuzione nel tempo del gambero autoctono A. pallipes e alloctono P. clarkii
Impatti sanitari
I problemi legati alla coesistenza delle due specie in uno stesso ambiente non riguardano solo il rapporto di predazione o di competizione per le risorse alimentari e per quelle territoriali, ma anche la possibilità di trasmissione di malattie e parassiti. Le specie alloctone sono potenziali importatori e vettori di malattie e parassiti dal loro luogo di provenienza a quello d’inserimento e possono trasmetterle agli organismi autoctoni. Uno dei principali fattori di rischio è la presenza di flora microfungina sulla cuticola di P. clarkii, in quanto potenzialmente patogena per la flora e la fauna autoctona. La patologia più pericolosa e dannosa è la “Peste del gambero” il cui agente patogeno è l’oomicete Aphanomyces astaci Schikora (1906). Le specie Nord Americane come Procambarus clarkii, Pacifastacus leniusculus e Orconectes limosus sono ben adattate alla presenza di A. astaci, manifestando l’infezione solo a livello subclinico (latente, benigna o cronica). Pur non sviluppando la malattia, possono comunque agire da portatori sani, diffondendo le zoospore nell’ambiente e conseguentemente raggiungere la cuticola dei nuovi ospiti. Le specie di gamberi europee sono, invece, suscettibili all’infezione e presentano una melanizzazione più lenta perché il sistema immunitario dei gamberi non è in grado di reagire prontamente. In passato, il gambero rosso ha causato l’estinzione di varie popolazioni locali di A. pallipes e Astacus astacus in Europa, contribuendo a diffondere questa grave patologia, l’aphanomycosi, letale per le specie indigene europee. I gamberi infetti non sopravvivono e la mortalità raggiunge il 100% in poche settimane dall’esposizione (Alderman et al., 1987). Contro questa terribile patologia non esiste tuttora rimedio o antidoto. Non è solo l’afanomicosi che infierisce negativamente sulle popolazioni residue del gambero nativo ma anche Fusarium oxysporum Schltdl. (1824) che causa affezioni alle branchie dei crostacei, inducendo melanizzazione acuta. La presenza di ferite superficiali ne può favorire la penetrazione nel tegumento. Altre importanti patologie che colpiscono i crostacei sono principalmente dovute a Fusarium solani (Mart.) Sacc. (1881), Fusarium tabacinum (J.F.H. Beyma) e Fusarium melanochlorum (Casp.) Sacc. (1886). La melanizzazione dell’esoscheletro comunemente nota come “burn spot disease” o ruggine del gambero è il sintomo più frequentemente visibile e impedisce ai crostacei di compiere la muta e, dunque, di crescere. Nel lago Trasimeno, analisi effettuate sull’esoscheletro di 86 esemplari di P. clarkii nell’arco di un anno solare hanno rivelato un’elevata diversità di specie fungine; 33 taxa per 20 generi. L’Oomicete patogeno Aphanomyces astaci non è mai stato riscontrato. Phoma glomerata, nuova specie per le acque dolci italiane (Dörr et al., 2011), rappresentava la specie dominante, riscontrata nel 67.4% degli individui. La presenza di P. glomerata è stata rilevata in tutti i mesi di campionamento. Questo potrebbe significare che la sua presenza sulla cuticola non sia semplicemente conseguente all’ambiente con cui esso viene a contatto, ma che vi possa essere un’associazione con il gambero. Phoma glomerata è riportata come specie ubiquitaria, isolata da un centinaio di ospiti vegetali (White & Morgan-Jones, 1987). Purtroppo, Phoma glomerata è coinvolta anche in diverse patologie a carattere micotico negli animali e nell’uomo, dove il patogeno colpisce le estremità degli arti e gli organi riproduttivi. Cladosporium cladosporioides, Penicillium sp. e Fusarium sp. sono stati riscontrati con una frequenza relativamente alta. Fusarium sp. risulta dannoso per le piante ed è agente causale di importanti patologie a livello mondiale (Domsch & Gams, 1980), ma è anche spesso associato a patologie della fauna ittica e può causare effetti negativi sulla pesca alieutica e professionale, un’importante attività produttiva del lago Trasimeno. Date le abitudini fossorie di P. clarkii, sono stati ritrovati Acremonium kiliense, Aspergillus terreus, Fusarium dimerum, Fusarium oxysporum e Rhizopus stolonifer, specie tipiche nel suolo. È, invece, inattesa l’osservazione di microfunghi strettamente associati alla vegetazione: Aureobasidium pullulans è segnalato quale saprotrofo di materiale vegetale, mentre Microdochium bolleyi è strettamente associato a particolari vegetali, quali radici di 121 graminacee. Sono inoltre state riscontrate alcune specie interessanti, in quanto poco comuni (in generale e in ambiente acquatico) o perché segnalate come dannose per la flora e la fauna, nonché per la salute umana e riportati nell’Atlas of Clinical Fungi (de Hoog et al., 2000). Fanno parte di questi le seguenti specie microfugine identificate sulla cuticola del gambero rosso del lago Trasimeno: Acremonium kiliense, Aspergillus candidus, Aspergillus fumigatus, Aspergillus terreus, Aureobasidium pullulans, Fusarium dimerum, Fusarium oxysporum, Fusarium verticillioides, Paecilomyces lilacinus e Penicillium chrysogenum. Un’elevata presenza di colonie batteriche è stata riscontrata nel 58% degli individui e merita attenzione il fatto che anche i batteri possono essere pericolosi. Infatti, come riportato da Anda et al. (2001), sono stati registrati due episodi di tularemia umana in Spagna, causata da Francisella tularensis che ha colpito 585 pazienti, venuti a contatto con questo patogeno pescando o manipolando esemplari di P. clarkii.
Eradicazione, contenimento e controllo
L’eradicazione di popolazioni di gamberi alieni è a oggi rara e può essere svolta con successo solo se l’ambiente di diffusione è molto limitato spazialmente. Per la maggior parte delle popolazioni già insediatesi sul territorio, l’unica opzione attuabile ed economicamente conveniente è quella di adottare una politica di contenimento o di controllo utilizzando strumenti di mitigazione che riescano a ridurre la loro densità a livelli molto bassi. In realtà si tratta della raccolta o dell’eliminazione di una frazione più o meno ampia di una popolazione in modo continuativo riducendo cosi l’impatto negativo. Tra i metodi comunemente utilizzati per contenere numericamente popolazioni di P. clarkii sono riportati: il controllo meccanico, chimico e biologico inclusa la sterilizzazione dei maschi. Il controllo meccanico, cioè la rimozione fisica da un ambiente di popolazioni di crostacei confinate effettuata seguendo il principio “catturane più che puoi”, è una strategia di contenimento che può portare a discreti risultati solo, se condotta per un periodo di tempo prolungato, con notevoli costi ed un alto impiego di manodopera. In Nord America, il controllo dei crostacei alloctoni è stato effettuato con trappole di diversa struttura e dimensioni munite da svariati tipi di esche alimentari. I metodi di lotta biologica tradizionali comprendono l’immissione di specie ittiche predatrici autoctone, ma hanno prodotto solo scarsi risultati nel contenimento delle popolazioni di P. clarkii in Italia (Aquiloni et al., 2010).
Le anguille, i persici e il luccio sono efficaci predatori di gamberi, anche se tendenzialmente predano solo individui di piccola o media taglia.
L’anguilla, invece, esercita anche un effetto indiretto sul gambero rosso disturbandolo nei rifugi e riducendo la sua attività trofica (Aquiloni et al., 2010). Il controllo biologico può essere eseguito anche mediante l’uso di esche con feromoni sessuali, che attraendo i maschi nel periodo riproduttivo, potrebbero accrescere il successo di trappolaggio. Un ulteriore metodo per contenere la specie indesiderata è la Sterile Male Release Thecnique (SMRT) che consiste nella sterilizzazione dei maschi, senza causare importanti modificazioni del comportamento sessuale, e il loro successivo rilascio in natura. La metodologia è sicura per l’ambiente in quanto viene effettuata solo sulla specie presa in considerazione e senza modificare gli equilibri dell’ecosistema: la tecnica non è molto costosa e non richiede tempi lunghi di esecuzione. Un ulteriore metodo di controllo è quello chimico con biocidi come gli organofosfati (aldrin), piretroidi e il rotenone che sono potenzialmente molto efficaci per contenere ed addirittura eradicare la specie, ma spesso mancano di specificità rischiando di eliminare anche gli invertebrati autoctoni. È inoltre probabile che queste sostanze si possano bioaccumulare nella rete trofica. Nonostante i risultati contrastanti raggiunti con i metodi sopra elencati, un approccio integrato delle diverse tecniche appare la strategia migliore per raggiungere un discreto successo nel ridimensionare le popolazioni di Procambarus clarkii. In realtà la migliore strategia per contrastare la diffusione e dispersione di questa specie invasiva è impedire il suo accesso al territorio prevenendo il suo arrivo. In effetti, il costo della prevenzione da un’invasione di crostacei alloctoni è irrisorio se comparato con qualsiasi altra misura adottata quando essi si sono già acclimatati (Vander Zanden et al., 2010). È importante capire la via d’ingresso della specie invasiva sul territorio (analisi dei “pathway”). In DAISIE (Delivering Alien Invasive Species Inventories for Europe) è presente una lista che indica le principali vie d’ingresso per le specie acquati che alloctone e, tra queste, le più importanti per P. clarkii sono: acquacoltura, pesca sportiva e professionale e scopo ornamentale nell’acquariofilia. In acquacoltura la specie introdotta viene stabulata in impianti per scopi commerciali, il che non esclude però la possibilità di fughe dall’allevamento, permettendo ad essa di arrivare via canali a corsi d’acqua, stagni e laghi. La pesca sportiva e professionale è un altro veicolo di dispersione poiché le specie introdotte vengono utilizzate come cibo o esche vive per pesci. Lo scopo ornamentale per l’acquariofilia è tra le principali cause della diffusione delle specie di gamberi d’acqua dolce che vengono importate da tutto il mondo anche in associazione ad altro materiale vivo. La vendita a scopo ornamentale è prassi comune in tutta Europa (Chucholl, 2012) e, sebbene P. clarkii rientri tra le 100 specie invasive più pericolose, veniva comunemente venduto o fornito nella maggior parte dei negozi per animali da compagnia a prezzi accessibili (meno di 10 euro l’uno). In Umbria il gambero rosso veniva venduto fino a poco tempo fa alla fiera dei morti al posto del pesciolino rosso perché più resistente alla manipolazione da parte dei bambini o di persone non esperte. Una percentuale degli esemplari acquistati, e soprattutto la loro numerosa prole, viene prima o poi rilasciata in natura dove può acclimarsi e dopo pochissimo tempo divenire invasiva (Aquiloni et. al., 2014). P. clarkii, così come anche Orconectes limosus, è stato inserito nell’elenco delle specie esotiche invasive di rilevanza unionale del Regolamento UE n. 1143/2014 adottato dal Regolamento di esecuzione 2016/1141 che prevede l’attuazione di misure efficienti per prevenirne nuove introduzioni o un’ulteriore diffusione nel territorio dell’Unione; promuovere il rilevamento precoce e l’eradicazione rapida delle specie, e gestirle, anche attraverso la pesca, la caccia, la cattura o qualsiasi altro tipo di raccolta per il consumo o l’esportazione.
Ringraziamenti
Gli autori ringraziano Striglio Stefano per il contributo garfico.
Bibliografia
Alderman D.J., Polglase J.L. 1986. Aphanomyces astaci: isolation and culture. Journal of Fish Diseases 9: 367-379.
Anda P., Segura del Pozo J., Díaz García J. M. Escudero R., García Peña F. J., López Velasco M. C., Sellek R. E., Jiménez Chillarón M. R., Sánchez Serrano L.P., Martínez Navarro J. F. 2001. Waterborne Outbreak of Tularemia Associated with Crayfish Fishing. Emerging Infectious Diseases 7(3): 575-582.
Aquiloni L., Brusconi S., Cecchinelli E., Tricarico E., Mazza G., Paglianti A., Gherardi F. 2010. Biological control of invasive populations of crayfish: the European eel (Anguilla Anguilla) as a predator of Procambarus clarkii. Biological Invasions 12 (11): 3817-24.
Aquiloni L., Giovannelli F., Mazza G., Inghilesi A. F., Scapini F. 2014. Gli impatti prodotti dal gambero invasivo e le principali vie d’ingresso della specie in Friuli Venezia Giulia. In: “RARITY. Eradicazione del gambero rosso della Louisiana e protezione dei gamberi di fiume del Friuli Venezia Giulia”. Progetto RARITY, Life10 NAT/IT/000239, pp. 144.
Chucholl C. 2012. Invaders for sale; trade and determinants of introduction of ornamental freshwater crayfish. Biological Invasions. Correia A.M. 2003. Food choice by the introduced crayfish Procambarus clarkii. Annales Zoologici Fennici 40:517-528.
de Hoog G.S., Guarro J., Gené J., Figueras M.J. 2000. Atlas of clinical fungi, 2nd ed. Centraalbureau voor Schimmelcultures, Utrecht, The Nether Netherlands, pp. 1126.
Delmastro M. 1992. Sull’acclimatazione del gambero della Louisiana Procambarus clarkii (Girard, 1852) nelle acque dolci italiane. Pianura – Supplemento di Provincia Nuova, N 4/1992: 5-10.
Domsch K.H., Gams W. 1980. Compendium of soil fungi. Academic Press, London, pp. 859.
Dörr A.J.M. Pedicillo G., Lorenzoni M. 2001. Prima segnalazione in Umbria di Procambarus clarkii (Girard), Orconectes limosus (Rafinesque) e Astacus Leptodactylus Eschscholtz (Crustacea Decapoda). Rivista di Idrologia 40: 2-3
Dörr A.J.M.,La Porta G, Pedicillo G, M. Lorenzoni (2006).Procambarus clarkii (Girard, 1852) in Lake Trasimeno: biology and ecology. BFPP. Bull Français de La Pêche et de la Protection des Milieux Aquatiques, 380-381, 1155-1168.
Dörr A.J.M., Rodolfi M., Scalici M., Elia A.C., Garzoli L., Picco A.M. 2011. Phoma glomerata, a potential new threat to Italian inland waters. Journal for Nature Conservation 19: 370-373.
Dörr A.J.M., M. Scalici M. 2013. Revisiting reproduction and population structure and dynamics of Procambarus clarkii eight years after its introduction into Lake Trasimeno (Central Italy). Knowledge and Management of Aquatic Ecosystems. 408, 10-16
Füreder L., Gherardi F., Holdich D., Reynolds J. Sibley P., Southy-Grosset C., 2010. ustropotamobius pallipes. In : IUCN 2010. IUCN Red List of Threatened Specioes. Version 2017-3. Downloaded on 29 January 2018
Garcia-Berthou E. 2005. Introduction pathways and establishment rates of invasive aquatic species in Europe. Canadian Journal of Fisheries and Aquatic Sciences 62: 453-463.
Geiger W., Alcorlo P., Baltanas A., Montes C. 2005. Impact of an introduced crustacean on the trophic webs of Mediterranean wetlands. Biological Invasion 7: 49-73.
Gutiérrez-Yurrita P., Montes C., 1999. Bioenergetics and phenology of reproduction of the introduced red swamp crayfish, Procambarus clarkii, in Doñana National Park, Spain, and implications for species management. Freshwater Biology 42:561-574.
Hasburgo-Lorena A.S., 1986. The status of the Procambarus clarkii population in Spain. Freshwater Crayfish 6:131-136.
Hobbs H.H., Jess J.P., Huner J.V., 1989. A review of global crayfish introductions with particular emphasis on two north American species (Decapoda, Cambaridae). Crustaceana 56:299-316.
Holdich D.M., 1993. A review of astaciculture: Freshwater crayfish farming. Aquatic Living Resources 6:307-317.
Mancinelli G., Papadia P., Ludovisi A., Migoni D., Bardelli R., Fanizzi F. P., Vizzini S., 2018. Beyond the mean: A comparison of trace- and macroelement correlation profiles of two lacustrine populations of the crayfish Procambarus clarkii. Science of the Total
Environment 624 (2018) 1455–1466
Natali M., 2010 L’evoluzione della fauna ittica del lago Trasimeno. www.bibliocastiglione.it.
Regolamento di esecuzione (UE) 2016/1141 della commissione del 13 luglio 2016 che adotta un elenco delle specie esotiche invasive di rilevanza unionale in applicazione del regolamento (UE) n. 1143/2014 del Parlamento europeo e del Consiglio
Renai B., Gherardi F. 2004. Predatory efficiency of crayfish: comparison between indigenous and non-indigenous species.
Biological Invasions 6:89-99.
Traversetti L., Dörr A.J.M., Scalici M. 2016. The freshwater grass shrimp Palaemonetes antennarius in the diet of fish in Lake Bracciano (Central Italy) Knowledge and Management of Aquatic Ecosystems 417, 7.
Vander Zanden M. J., Ansen G. J. A., Higgins S. N., Kornis M. S. 2010. A pound of prevention, plus a pound of cure: early detection and eradication of invasive species in the Laurentian Great Lake. Journal of Great Lakes Research 36: 199-205.
White J.F.Jr., Morgan-Jones G. 1987. Studies in the genus Phoma. VII. Concerning Phoma glomerata. Mycotaxon 28:437-445.
Tratto da:

"Caratterizzazione e diffusione delle specie aliene acquatiche e di ambienti umidi in Umbria"
Anno di pubblicazione 2019
Arpa Umbria
Autori vari / a cura di Valentina Della Bella, Arpa Umbria